10月29日,国家药监局发布公告,对门冬氨酸鸟氨酸注射剂(包括门冬氨酸鸟氨酸注射液、注射用门冬氨酸鸟氨酸)说明书【不良反应】、【注意事项】、【禁忌】、【孕妇及哺乳期妇女用药】、【儿童用药】、【老年用药】项进行修订。
关于门冬氨酸鸟氨酸注射剂
门冬氨酸鸟氨酸为肝病用药,适用于因急、慢性肝病(如各型肝炎、肝硬化、脂肪肝、肝炎后综合症)引发的血氨升高及治疗肝性脑病,尤其适用于治疗肝昏迷早期或肝昏迷期的意识模糊状态。目前国内市场上市销售的门冬氨酸鸟氨酸注射剂有门冬氨酸鸟氨酸注射液及注射用门冬氨酸鸟氨酸。此次修订,要求在【不良反应】项要求包含以下内容:上市后监测数据显示本品可见肠胃损害、神经系统损害等多项不良反应/事件病例报告(发生率未知)。【孕妇及哺乳期妇女用药】项中应包含以下内容:尚无孕妇使用门冬氨酸鸟氨酸注射液的临床研究数据。仅在动物试验中对门冬氨酸鸟氨酸进行了有限的生殖毒性研究。建议避免在怀孕期使用门冬氨酸鸟氨酸等内容。【儿童用药】、【老年用药】项中需注明未进行该项试验且无可参考文献。此外增加多个【注意事项】。据米内网数据显示,2019年中国公立医疗机构终端门冬氨酸鸟氨酸注射剂销售额超过10亿元。
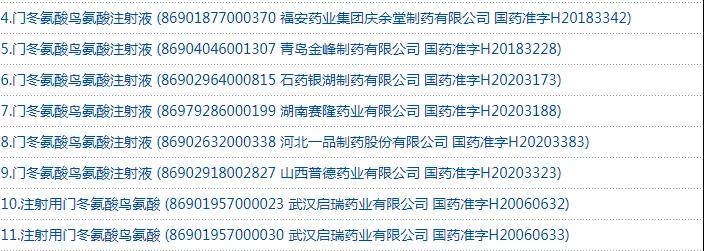
经查询国家药监局网站,门冬氨酸鸟氨酸注射剂共有8个注册批文,涉及石药银湖制药、河北一品制药等7家企业。据了解,目前还有扬子江药业集团广州海瑞药业、成都倍特药业等20家企业的上市申请在审评审批中。
2020年已有15个注射剂被要求修订说明书
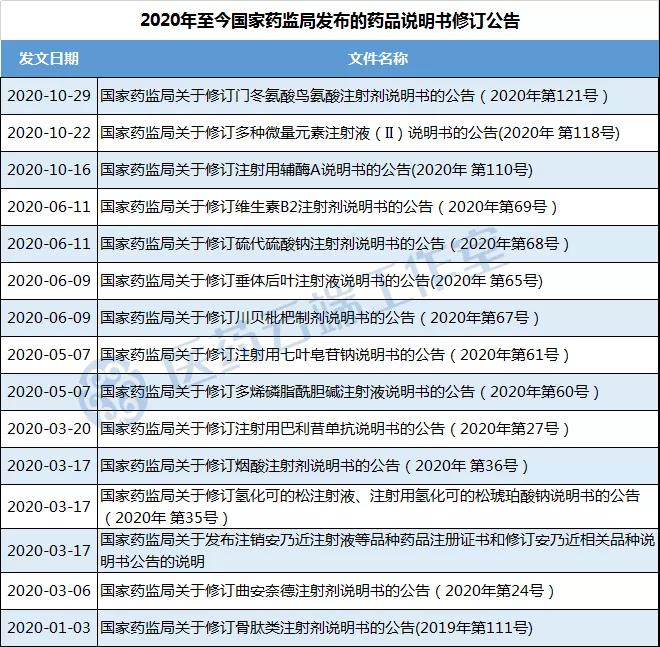
《国家药品不良反应监测年度报告(2017年)》显示,2017年中药不良反应/事件报告数量比2016年略有下降。2017年药品不良反应/事件报告涉及的药品给药途径分布中,注射给药占整体报告的64.7%,严重报告中涉及注射给药途径的占77.6%;按照给药途径分布,静脉注射给药占54%,其他注射给药占0.6%。药品说明书信息的规范与完整,对患者用药及医师指导起着关键作用,近年来国家不断加强药品不良反应监测特别是注射剂品种,发布了多则药品修订说明书公告。据医药云端工作室统计,2019年至今,国家药监局共发布39则药品说明书修订公告,其中涉及的注射剂有13个。
上市后监测数据显示本品可见以下不良反应/事件病例报告(发生率未知):免疫功能紊乱和感染:过敏样反应、过敏反应、过敏性休克;1.上市后监测到本制剂有过敏性休克的病例报告,建议在有抢救条件的医疗机构使用,用药前应仔细询问患者用药史和过敏史,用药过程中注意观察,一旦出现过敏反应或其他严重不良反应须立即停药并及时救治。2.用药过程中,应密切观察用药反应,特别是开始30分钟,发现异常,应立即停药,采取积极救治措施。3.有文献报道,门冬氨酸鸟氨酸与维生素K1等存在配伍禁忌,为保证用药安全,尽量避免连续静点门冬氨酸鸟氨酸和上述药品,如果连续静点,中间可以用生理盐水对输液管道进行冲洗,确保用药安全。4.如果患者的肝功能损伤严重,输液速度必须根据患者的个体情况来调整,以免引起恶心和呕吐。5.门冬氨酸鸟氨酸治疗过程中,由于疾病程度不同,驾驶和机械操作的能力会有不同程度影响。对于本品中任何成份过敏者禁用。严重肾功能不全的患者(诊断标准是血清中肌酐水平超过3mg/100ml)禁用。仅在动物试验中对门冬氨酸鸟氨酸进行了有限的生殖毒性研究。建议避免在怀孕期使用门冬氨酸鸟氨酸。如果认为必须使用门冬氨酸鸟氨酸治疗,则应谨慎评估风险与获益。尚未知门冬氨酸鸟氨酸是否进入母乳,建议避免在哺乳期使用门冬氨酸鸟氨酸。如果认为必须使用门冬氨酸鸟氨酸治疗,则应谨慎评估风险与获益。(注:说明书其他内容如与上述修订要求不一致的,应当一并进行修订。)




